来源: 有机化学大讲堂基础课程片段——第1讲-原子的电子构型
原子的电子构型
一、四个量子数
我们习惯用四个量子数描述原子外层电子轨道的波函数
- 主量子数: 用n表示,可取1, 2, 3, … ,分别用K, L, M, N, O, P等表示。可将主量子数描述为电子主层
- 角量子数: 用L表示,与主量子数n有关,只能取0, 1, 2, … , n-1,分别叫s, p, d, f, g, h。可将角量子层数描述为电子亚层
- 磁量子数: 用m表示,与角量子数L有关,只能取0, ±1, ±2, …, ±L。用以描述各电子亚层含多少个电子轨道、轨道的形状和方向。
- 自旋量子数: 描述各电子轨道最多只能容纳两个电子,且必须自旋相反
| n |
电子主层名称 |
L |
各主电子层由哪些电子亚层组成 |
电子主层的电子亚层构成 |
主电子层最多容纳电子数() |
| 1 |
K |
0 |
s |
1s |
2 |
| 2 |
L |
0, 1 |
s, p |
2s, 2p |
2+6=8 |
| 3 |
M |
0, 1, 2 |
s, p ,d |
3s, 3p, 3d |
2+6+10=18 |
| 4 |
N |
0, 1, 2, 3 |
s, p ,d, f |
4s, 4p, 4d, 4f |
2+6+10+14=32 |
| …… |
…… |
…… |
…… |
…… |
…… |
| L |
电子亚层名称 |
m |
各电子亚层含的轨道数 |
电子轨道内的自旋电子 |
电子亚层最多容纳电子数 |
| 0 |
s |
0 |
1 |
↑↓ |
2 |
| 1 |
p |
0, ±1 |
3 |
↑↓ ↑↓ ↑↓ |
6 |
| 2 |
d |
0, ±1, ±2 |
5 |
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ |
10 |
| 3 |
f |
0, ±1, ±2, ±3 |
7 |
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ |
14 |
| …… |
…… |
…… |
…… |
…… |
…… |
二、原子的核外电子排布
每个原子的核外电子数是一定的,其核外电子排布满足能量最低原理、Pauli不相容原理和Hund规则
- 能量最低原理:核外电子轨道的能量高低不等,其能级顺序为——1s<2s<2p<3s<3p<4s<3d<4p…
- Pauli不相容原理:每个电子轨道最多容纳两个电子,且必须自旋相反,即s, p, d, f电子亚层最多只能容纳2, 6, 10, 14个电子
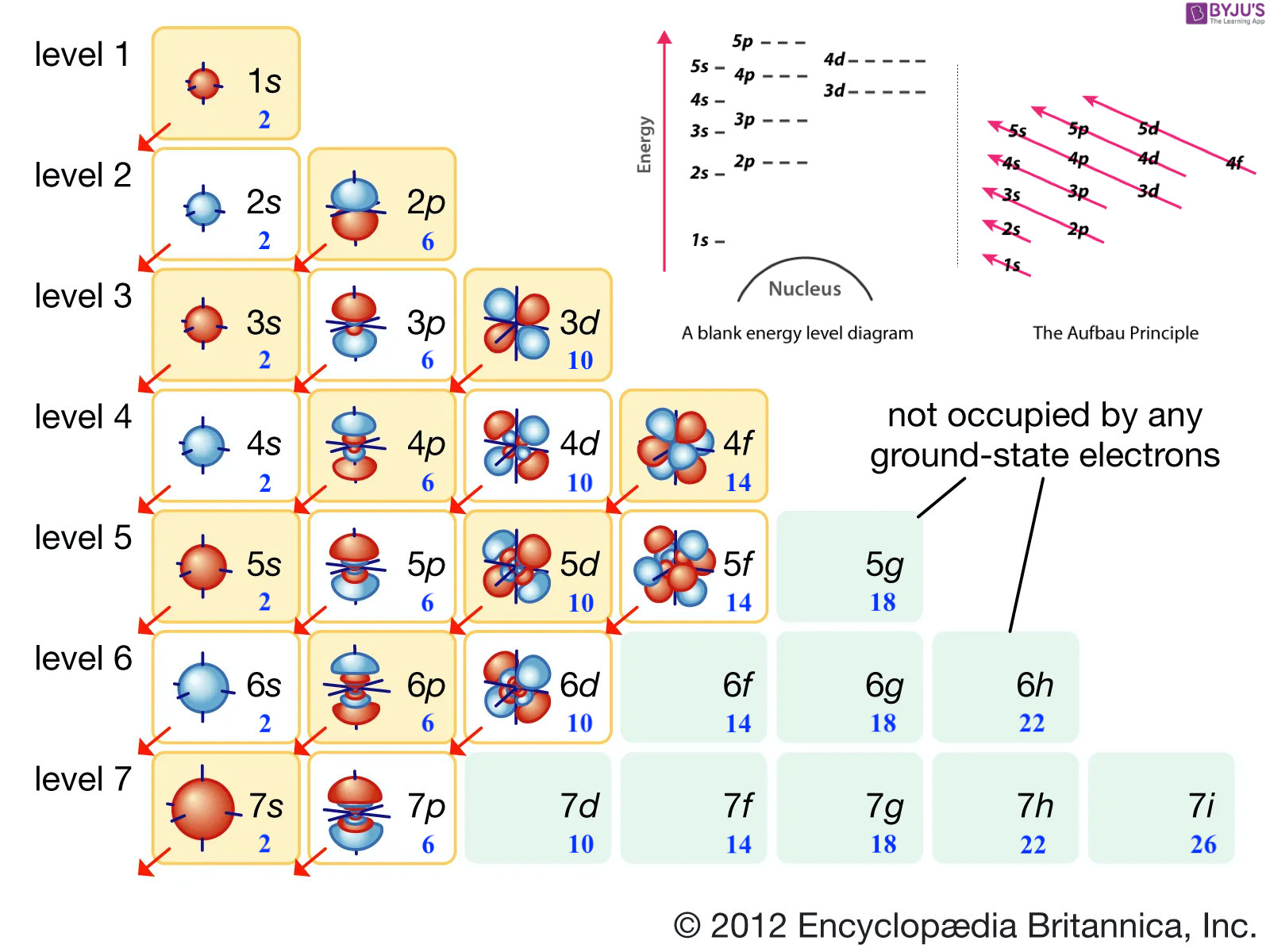
1
2
3
4
5
6
7
| 1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f 5g
6s 6p 6d 6f 6g 6h
7s 7p 7d 7f 7g 7h 7i
|
- Hund规则:在能量相同的轨道上,电子总是先以自旋方向相同尽量分占不同的轨道以使原子能量最低
- *特例:等价轨道全充满、半充满和全空状态比较稳定(此时能量有所降低,整体能量低于跃迁至更高轨道所需的能量——视具体能量高低的情况仅适用某些特例情况,不是所有)
| 原子 |
核外电子数 |
1s |
2s |
2p |
3s |
3p |
4s |
3d |
| ELEMENT |
MAX |
2 |
2 |
6 |
2 |
6 |
2 |
10 |
| C |
6 |
[↑↓] |
[↑↓] |
[↑,↑,☐] |
[☐] |
[☐,☐,☐] |
[☐] |
[☐,☐,☐,☐,☐] |
| K |
19 |
[↑↓] |
[↑↓] |
[↑↓,↑↓,↑↓] |
[↑↓] |
[↑↓,↑↓,↑↓] |
[↑] |
[☐,☐,☐,☐,☐] |
| *Cr |
24 |
[↑↓] |
[↑↓] |
[↑↓,↑↓,↑↓] |
[↑↓] |
[↑↓,↑↓,↑↓] |
[↑] |
[↑,↑,↑,↑,↑] |
| *Cu |
29 |
[↑↓] |
[↑↓] |
[↑↓,↑↓,↑↓] |
[↑↓] |
[↑↓,↑↓,↑↓] |
[↑] |
[↑↓,↑↓,↑↓,↑↓,↑↓] |
来源: 有机化学大讲堂基础课程片段-第2讲-价键理论(一)
将分子中原子结合到一起的作用力称为化学键,化学键分为离子键、金属键和共价键
离子键:依靠正负离子间的静电引力形成的化学键称为离子键。如NaCl晶体中Na+和Cl-之间的化学键。
金属键:金属原子最外层的价电子很容易脱离原子核的束缚,然后自由地在由正离子产生的势场中运动,这些自由电子与正离子相互吸引,使原子紧密堆积起来,形成金属晶体,这种使金属原子结合成金属晶体的化学键称之为金属键。
共价键:两个或多个原子通过共用电子对而产生的一种化学键称为共价键。
共价键理论分为经典共价键理论和现代共价键理论,现代共价键理论分为现代价键理论和分子轨道理论。
